
2021年08月25日
1年遅れの東京2020オリンピックは、新型コロナウイルスのパンデミックで開催について賛否両論ではありましたが、いざ開催してみると5年間目指してきたオリンピックという舞台でアスリートたちの活躍は目覚ましく、多くの色々な色のメダルを日本にもたらしてくれました。
アスリートやボランティアの皆様お疲れ様でした、コロナの暗い世相に灯りをともしてくれて有難うございました。
これからパラリンピックが始まりますが、コロナウイルスPCR陽性者が増加しているのが気になるところではあります。
さて、今日は、「どこからGMP?」というテーマでお話ししたいと思います。
「えっ?どこからGMPってどういう意味なの?」と訝しく思われる方もいらっしゃる事と思います。
研究がうまくいって開発段階になり、バイオ医薬品の原薬の作業工程が複雑で「この工程全部をGMP対応で治験をしなくてはならないとしたら…治験薬の製造段階で潤沢な予算も無いし、開発を諦めなくてはいけないのかな?」と考えていらっしゃるとしたら、少し待ってください。
例えば、ウイルスを使った遺伝子細胞治療の製造工程は複雑です。
また、バイオ医薬品の中でも遺伝子細胞治療に使用する細胞医薬品は大変費用が嵩みます。治験(Phase1など)の段階で、使用する原材料の全てをGMP基準で製造しなければならないとしたら…費用や製造期間などの点で躊躇すると思います。
複雑な工程では、初期段階の工程は、GMP原薬のための原材料の製造工程として位置づけることができるので、必ずしもGMP製造とGMP/GLP試験までをフルで実施しなくても良いです。
AAV製造を例にとってご説明したいと思います。
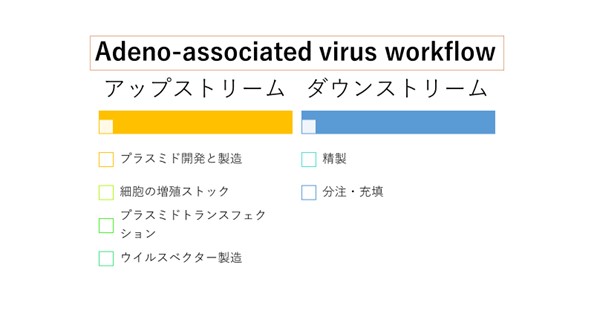
AAV製造のためには、大量のプラスミドを得る必要があります。
これをGMP製造するとしますと、大腸菌のリサーチセルバンク(RCB)を作り、更にマスターセルバンク(MCB)やワーキングセルバンク(WCB)を製造し、ICHのガイドラインに沿ったセルバンク試験をすべて実施します。更に、non-GMP製造を実施してSOPを作成し、GMP製造を実施して、また、ICHガイドラインに沿ったロットリリース試験となります。
費用もさることながら、期間も約1年を要します。
ただ、AAV製造の場合には、プラスミドを直接患者様の細胞に投与するわけではなく、あくまでもウイルス製造のためのツールとして用いますので、GMP製造とほぼ同等の品質を担保し、後々の工程に影響しないように必要な品質試験のみを実施するということで良いと思います。
要は、プラスミド製造用の品質試験はロットリリース試験ではなく、あくまでも後々の工程に影響しないようにということを念頭にRCBとRCBの段階での大腸菌としての品質の担保をいわゆる工程試験のような感じで実施するというようなイメージです。
プラスミドの製造に際しては、品質試験を実施したRCBを用いて、GMP製造と同等の試薬と工程を実施して製造し、最低限の試験を実施します。
通常は、AAV製造用のHEK293細胞のセルバンク製造と品質試験(GLP試験)が必要になりますが、当社(提携先のTFBS)では、AAV製造用のHEK293細胞はGMP製造を実施して、必要なセルバンク試験(GLP試験)を実施したMCBを有しておりますので、これをご使用いただくことが可能です。
準備した細胞にトランスフェクション(GMP)をしてAAVが得られたらAAVの精製工程です。AAVの精製工程では、超遠心法やクロマト精製を実施して品質を担保します。
精製後のAAVをGMP原薬として位置づけます。
精製後の原薬は、ガイドラインに則って下記の試験を実施します。
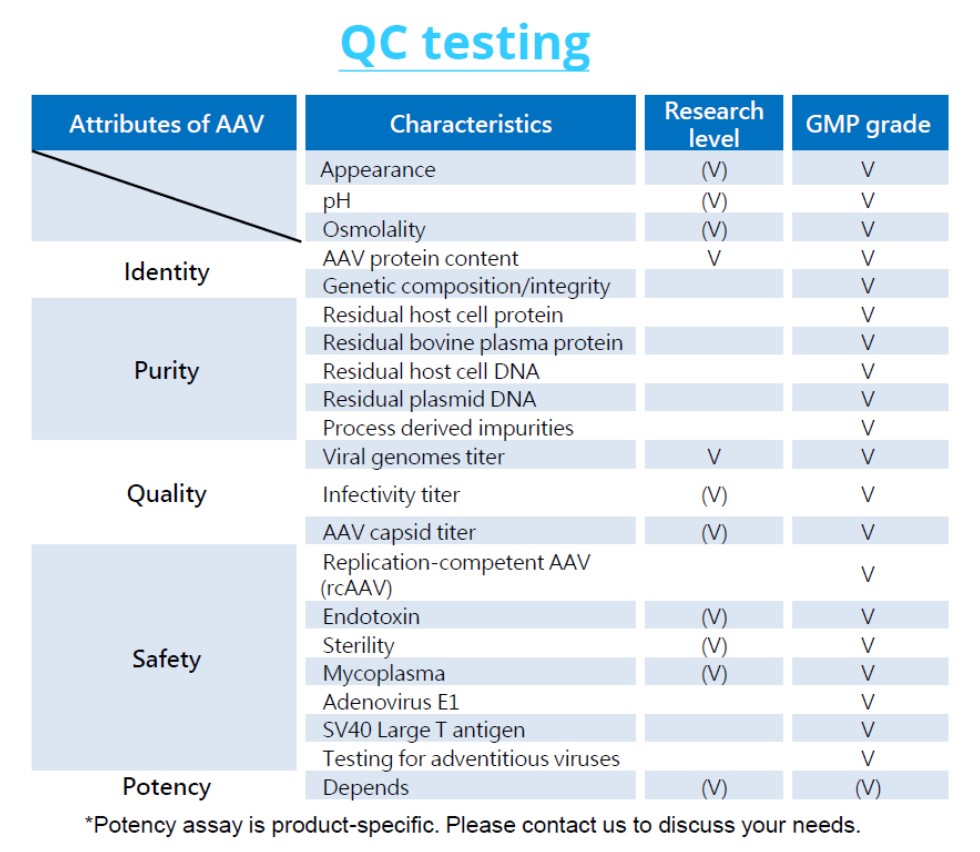
原薬は、分注・充填の製剤化工程(GMP)を経て、製剤化されたウイルスについては、ICHガイドラインに則ったGLP/GMPロットリリース試験を実施します。
上流の工程については、原薬や製剤になった時に上流の工程で問題があった場合に発見できるような品質試験が必要という事になります。
治験薬を製造するためには、実際にはPMDAと事前相談や戦略相談などで相談しながら進めることになると思います。
メディリッジでは、製造や試験だけでなく、コンサルティングもお受けすることができますので、必要に応じてご相談頂ければと思います。
